Al ducharnos, cada uno de nosotros se echa champú en la cabeza, porque su madre lo educó así. De hecho, algunos pensarán que el champú solo sirve quizás para salir del cuarto de baño oliendo a limpito, y que una ducha sin champú en el pelo tampoco será tan diferente que con el exclusivo uso del agua y una buena frotada de manos. Lo mismo podemos decir con el jabón, ¿quién no se ha lavado las manos solo con agua, pensando, "si es lo mismo, hombre"?
Pero lo cierto es que el champú y el jabón, en la relación agua - grasa, tiene una fuerte y necesaria implicación. Sucede que la grasa es insoluble en el agua, o dicho más técnicamente, es hidrofóbica (fobia al agua). Esto significa que la grasa no se disolverá efectivamente con el agua, ya que son compuestos químicos que tienden a evitarse.
Sin embargo, tanto el jabón como el champú tienen una característica esencial. Sus moléculas son anfipáticas, es decir, por una extremo son solubles en el agua (cabeza hidrófila -acepta el agua-), y por otra no (cabeza hidrófoba -odia el agua-). Y además, la hidrofilia y la lipofilia (capacidad de ser solubles con las grasas) son características opuestas. Un compuesto, si es hidrófilo (aceptan el agua) es a su vez lipófobo (odian la grasa), y viceversa, un compuesto hidrófobo (odia el agua) es a su vez siempre lipófilo (aceptan las grasas).
Por tanto, una molécula anfipática como el jabón tiene una cara que acepta el agua y repele las grasas, y otra que repele el agua y acepta las grasas. Y gracias a las moléculas anfipáticas, se pueden crear disoluciones que, sin su presencia, serían imposibles.Por ejemplo, imaginemos que echamos aceite encima del agua. Olvidemos por un momento que el agua tiene mayor densidad que el aceite. El aceite flotaría por encima del agua dado que no puede formar disoluciones con ésta, dado que el aceite es hidrófobo (odia el agua). Si nosotros aplicamos un poquito de jabón, en la frontera donde acaba el agua y empieza el aceite, ocurrirá el siguiente fenómeno químico.

Las cabezas hidrófobas (lipófilas) del jabón se anexarán a partículas de aceite, y las otras cabezas a partículas de agua, ordenándose todas éstas en forma de mini esferzas con las "cabezas de grasa" en el centro, y las cabezas hidrófilas de cara al agua, como muestra la imágen anterior. Así, las partes hidrófilas protegen a sus cobardes hidrófobos, dándoles la cara al agua. De esta forma, cada "esfera", que recibe el nombre de micela, ya sí que es soluble en el agua. La disolución final será una mezcla homogénea de líquido (agua) con partículas sólidas (micelas), que reciben el nombre de coloide.
Cuando un compuesto es anfipático (que cada cabeza odia-acepta el agua), no siempre forma micelas en presencia de agua. Depende siempre de la naturaleza del compuesto y de las condiciones externas del mismo, por ejemplo, como ocurre en las células de nuestro cuerpo, o de cualquier organismo vivo. Podemos imaginar a una célula como una pequeña esfera de agua, rodeada por una membrana. Fuera de esa membrana, existe más agua. Pero dentro de esa membrana, es decir, en la misma célula, existen más compuestos químicos que flotan sobre el medio acuoso y que son los responsables del metabolismo y la reproducción de la célula: mitocondrias, cloroplastos, núcleo celular (donde reside el ADN de la célula), etc.
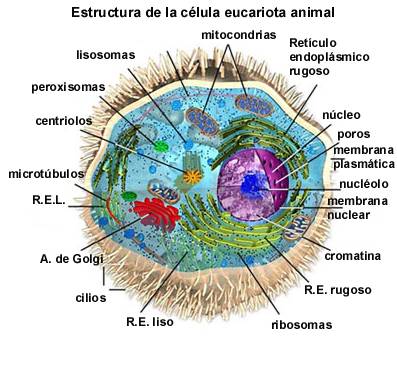
Cada uno de esos compuestos químicos puede verse como otra "minicélula", con sus propios orgánulos para realizar las funciones vitales de la célula hospedadora (evolutivamente hablando, la mayoría de estos orgánulos posiblemente fueron en su origen otras células adoptadas por la célula hospedadora, que luego olvidaron sus funciones vitales y se especializaron en la función que ahora desempeñan, de hecho, todas conservan su propia molécula de ADN).
Tanto la membrana de la célula, como las membranas de cada uno de los orgánulos, forman la frontera entre el agua presente en sus dos extremos: el interno y el externo. ¿Cómo os imaginais al compuesto químico que forman éstas membranas?, por supuesto, anfipático. Las membranas que rodean a las células y a sus orgánulos internos tienen una doble capa lipídica, es decir, dos capas de grasa, pero anfipáticas. La estructura de las moléculas de cada capa es como una medusa con dos colas, donde la cabeza acepta el agua, y cada cola la repele

La primera capa de grasa tiene a sus cabezas hidrófilas mirando hacia el interior de la célula, es decir, en contacto con el medio acuoso de la célula (citosol), mientras que las dos cabezas hidrófobas apuntan al exterior. Estas cabezas están, a su vez, mirando a las cabezas hidrófobas de la segunda capa, que tienen a sus respectivas cabezas hidrófilas de cara al agua que rodea a la célula.
Y una vez visto con claridad y algunos ejemplos los conceptos relacionados con la "anfipatía", volvamos al caso del champú y el jabón. ¿Cuál es su funcionamiento?. En éste punto todos podréis ya imaginarlo. Las moléculas de jabón/champú capturan a las moléculas de grasa, y forman micelas (las miniesferitas que comentamos antes), que se disuelven en el agua. Es decir, consiguen disolver la grasa en el agua siendo ellas las intermediarias.
¿En qué se diferencian entonces?, en que el jabón tiene una mayor "agresividad" en este tipo de reacciones, es decir, el champú es más débil a la hora de disolver la grasa en el agua, y la disuelve en menor cantidad, y es por ello que el champú es más adecuado para el lavado del pelo. El pelo, para su propia protección, va generando un material grasiento que se llama sebo. Este material es necesario para la propia salud del pelo y la protección frente a agentes externos. Pero las capas de sebo, si no son retiradas paulatinamente, se van acumulando, y al acumularse se convierten en sustancias pegajosas que capturan cualquier tipo de sustancia, como la gomina, la suciedad del aire, la grasa de las manos cuando nos tocamos el pelo, etc.
El champú, al aplicarselo al pelo, retira muchas capas de grasa pero no tiene suficiente fuerza como para disolver toda la grasa presente en ella, y éste es el objetivo preciso que necesitamos: eliminar la suciedad, y no la grasa natural que el pelo necesita para su propia protección. Al disolver solo las capas más externas de sebo, sin disolver las internas, retiramos solamente las capas de sebo que contienen suciedad. Y de ahí el consejo de que, lavarse muchas veces el pelo al día, es malo, porque puedes acabar retirando toda la grasa presente en ella, y de esa forma estropear el pelo.
El jabón, sin embargo, al tener mayor fuerza para disolver la grasa en el agua, es más apropiado para lavar, por ejemplo, la ropa, y además, debido a otras propiedades químicas que el jabón posee, tiene más capacidad que el champú para penetrar dentro del tejido y disolver los restos de grasa más profundos y escondidos.
Pero lo cierto es que el champú y el jabón, en la relación agua - grasa, tiene una fuerte y necesaria implicación. Sucede que la grasa es insoluble en el agua, o dicho más técnicamente, es hidrofóbica (fobia al agua). Esto significa que la grasa no se disolverá efectivamente con el agua, ya que son compuestos químicos que tienden a evitarse.
Sin embargo, tanto el jabón como el champú tienen una característica esencial. Sus moléculas son anfipáticas, es decir, por una extremo son solubles en el agua (cabeza hidrófila -acepta el agua-), y por otra no (cabeza hidrófoba -odia el agua-). Y además, la hidrofilia y la lipofilia (capacidad de ser solubles con las grasas) son características opuestas. Un compuesto, si es hidrófilo (aceptan el agua) es a su vez lipófobo (odian la grasa), y viceversa, un compuesto hidrófobo (odia el agua) es a su vez siempre lipófilo (aceptan las grasas).
Por tanto, una molécula anfipática como el jabón tiene una cara que acepta el agua y repele las grasas, y otra que repele el agua y acepta las grasas. Y gracias a las moléculas anfipáticas, se pueden crear disoluciones que, sin su presencia, serían imposibles.Por ejemplo, imaginemos que echamos aceite encima del agua. Olvidemos por un momento que el agua tiene mayor densidad que el aceite. El aceite flotaría por encima del agua dado que no puede formar disoluciones con ésta, dado que el aceite es hidrófobo (odia el agua). Si nosotros aplicamos un poquito de jabón, en la frontera donde acaba el agua y empieza el aceite, ocurrirá el siguiente fenómeno químico.

Las cabezas hidrófobas (lipófilas) del jabón se anexarán a partículas de aceite, y las otras cabezas a partículas de agua, ordenándose todas éstas en forma de mini esferzas con las "cabezas de grasa" en el centro, y las cabezas hidrófilas de cara al agua, como muestra la imágen anterior. Así, las partes hidrófilas protegen a sus cobardes hidrófobos, dándoles la cara al agua. De esta forma, cada "esfera", que recibe el nombre de micela, ya sí que es soluble en el agua. La disolución final será una mezcla homogénea de líquido (agua) con partículas sólidas (micelas), que reciben el nombre de coloide.
Cuando un compuesto es anfipático (que cada cabeza odia-acepta el agua), no siempre forma micelas en presencia de agua. Depende siempre de la naturaleza del compuesto y de las condiciones externas del mismo, por ejemplo, como ocurre en las células de nuestro cuerpo, o de cualquier organismo vivo. Podemos imaginar a una célula como una pequeña esfera de agua, rodeada por una membrana. Fuera de esa membrana, existe más agua. Pero dentro de esa membrana, es decir, en la misma célula, existen más compuestos químicos que flotan sobre el medio acuoso y que son los responsables del metabolismo y la reproducción de la célula: mitocondrias, cloroplastos, núcleo celular (donde reside el ADN de la célula), etc.

Cada uno de esos compuestos químicos puede verse como otra "minicélula", con sus propios orgánulos para realizar las funciones vitales de la célula hospedadora (evolutivamente hablando, la mayoría de estos orgánulos posiblemente fueron en su origen otras células adoptadas por la célula hospedadora, que luego olvidaron sus funciones vitales y se especializaron en la función que ahora desempeñan, de hecho, todas conservan su propia molécula de ADN).
Tanto la membrana de la célula, como las membranas de cada uno de los orgánulos, forman la frontera entre el agua presente en sus dos extremos: el interno y el externo. ¿Cómo os imaginais al compuesto químico que forman éstas membranas?, por supuesto, anfipático. Las membranas que rodean a las células y a sus orgánulos internos tienen una doble capa lipídica, es decir, dos capas de grasa, pero anfipáticas. La estructura de las moléculas de cada capa es como una medusa con dos colas, donde la cabeza acepta el agua, y cada cola la repele

La primera capa de grasa tiene a sus cabezas hidrófilas mirando hacia el interior de la célula, es decir, en contacto con el medio acuoso de la célula (citosol), mientras que las dos cabezas hidrófobas apuntan al exterior. Estas cabezas están, a su vez, mirando a las cabezas hidrófobas de la segunda capa, que tienen a sus respectivas cabezas hidrófilas de cara al agua que rodea a la célula.
Y una vez visto con claridad y algunos ejemplos los conceptos relacionados con la "anfipatía", volvamos al caso del champú y el jabón. ¿Cuál es su funcionamiento?. En éste punto todos podréis ya imaginarlo. Las moléculas de jabón/champú capturan a las moléculas de grasa, y forman micelas (las miniesferitas que comentamos antes), que se disuelven en el agua. Es decir, consiguen disolver la grasa en el agua siendo ellas las intermediarias.
¿En qué se diferencian entonces?, en que el jabón tiene una mayor "agresividad" en este tipo de reacciones, es decir, el champú es más débil a la hora de disolver la grasa en el agua, y la disuelve en menor cantidad, y es por ello que el champú es más adecuado para el lavado del pelo. El pelo, para su propia protección, va generando un material grasiento que se llama sebo. Este material es necesario para la propia salud del pelo y la protección frente a agentes externos. Pero las capas de sebo, si no son retiradas paulatinamente, se van acumulando, y al acumularse se convierten en sustancias pegajosas que capturan cualquier tipo de sustancia, como la gomina, la suciedad del aire, la grasa de las manos cuando nos tocamos el pelo, etc.
El champú, al aplicarselo al pelo, retira muchas capas de grasa pero no tiene suficiente fuerza como para disolver toda la grasa presente en ella, y éste es el objetivo preciso que necesitamos: eliminar la suciedad, y no la grasa natural que el pelo necesita para su propia protección. Al disolver solo las capas más externas de sebo, sin disolver las internas, retiramos solamente las capas de sebo que contienen suciedad. Y de ahí el consejo de que, lavarse muchas veces el pelo al día, es malo, porque puedes acabar retirando toda la grasa presente en ella, y de esa forma estropear el pelo.
El jabón, sin embargo, al tener mayor fuerza para disolver la grasa en el agua, es más apropiado para lavar, por ejemplo, la ropa, y además, debido a otras propiedades químicas que el jabón posee, tiene más capacidad que el champú para penetrar dentro del tejido y disolver los restos de grasa más profundos y escondidos.
¡¡Bachillerato me persiguee xD!!
ResponderEliminar